- Yazar Alex Aldridge [email protected].
- Public 2023-12-17 13:52.
- Son düzenleme 2025-06-01 07:38.
Birinci ve ikinci dereceden reaksiyonlar arasındaki temel fark, birinci dereceden reaksiyonların hızının, hız denklemindeki reaktan konsantrasyonunun birinci gücüne bağlıyken, ikinci dereceden reaksiyonların hızının konsantrasyonun ikinci gücüne bağlı olmasıdır. oran denklemindeki terim.
Bir reaksiyonun sırası, hız kanunu denkleminde reaktan konsantrasyonlarının yükseltildiği güçlerin toplamıdır. Bu tanıma göre çeşitli reaksiyon biçimleri vardır; sıfır derece reaksiyonlar (bu reaksiyonlar reaktanların konsantrasyonuna bağlı değildir), birinci derece reaksiyonlar ve ikinci derece reaksiyonlar.
Birinci Derece Tepkiler nelerdir?
Birinci dereceden reaksiyonlar, reaksiyon hızı, reaksiyona dahil olan reaktanlardan birinin molar konsantrasyonuna bağlı olan kimyasal reaksiyonlardır. Bu nedenle, reaksiyon düzeni için yukarıdaki tanıma göre, hız kanunu denkleminde artan reaktan konsantrasyonlarının güçlerinin toplamı her zaman 1 olacaktır. Bu reaksiyonlarda yer alan tek bir reaktan olabilir. Daha sonra bu reaktantın konsantrasyonu, reaksiyonun hızını belirler. Ancak bazen, bu reaksiyonlarda yer alan birden fazla reaktan vardır, o zaman bu reaktanlardan biri reaksiyonun hızını belirleyecektir.
Bu kavramı anlamak için bir örnek düşünelim. N2O5 ayrışma reaksiyonunda NO2 ve O oluşturur. 2 ürün olarak gazlar. Tek reaktanı olduğu için reaksiyonu ve hız denklemini aşağıdaki gibi yazabiliriz.
2N2O5(g) → 4NO2(g) + O 2(g)
Oran=k[N2O5(g)]m
Burada k, bu reaksiyon için hız sabitidir ve m, reaksiyonun sırasıdır. Bu nedenle, deneysel belirlemelerden m'nin değeri 1'dir. Dolayısıyla, bu birinci dereceden bir reaksiyondur.
İkinci Derece Reaksiyonlar nelerdir?
İkinci dereceden reaksiyonlar, reaksiyon hızı, reaksiyona girenlerden ikisinin molar konsantrasyonuna veya reaksiyona dahil olan bir reaktifin ikinci gücüne bağlı olan kimyasal reaksiyonlardır. Bu nedenle, reaksiyon sırası için yukarıdaki tanıma göre, hız kanunu denkleminde reaktan konsantrasyonlarının yükseltildiği güçlerin toplamı her zaman 2 olacaktır. İki reaktan varsa, reaksiyon hızı birinci güce bağlı olacaktır. her reaktan konsantrasyonunun.
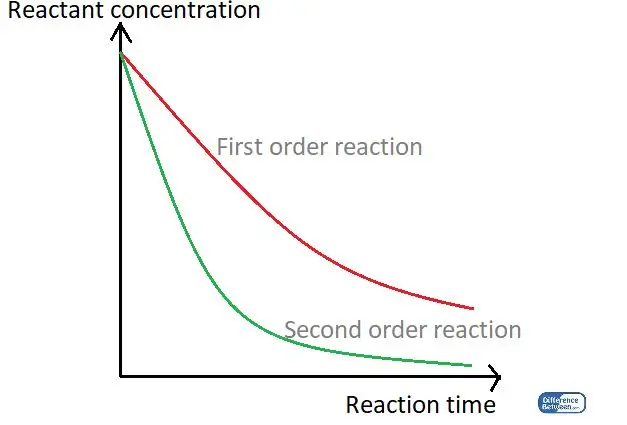
Şekil 01: Reaksiyon sürelerini ve reaktan konsantrasyonunu kullanarak iki tür reaksiyon düzenini karşılaştıran bir grafik.
Bir tepkenin konsantrasyonunu 2 kat arttırırsak (hız denkleminde iki tepken varsa), o zaman reaksiyon hızı 4 kat artar. Örneğin, aşağıdaki reaksiyonu ele alalım.
2A → P
Burada A bir reaktandır ve P üründür. O halde bu ikinci dereceden bir reaksiyon ise, bu reaksiyonun hız denklemi aşağıdaki gibidir.
Oran=k[A]2
Fakat aşağıdaki gibi iki farklı reaktantlı bir reaksiyon için;
A + B → P
Oran=k[A]1[B]1
Birinci ve İkinci Derece Reaksiyonlar Arasındaki Fark Nedir?
Birinci dereceden reaksiyonlar, reaksiyon hızı, reaksiyona dahil olan reaktanlardan birinin molar konsantrasyonuna bağlı olan kimyasal reaksiyonlardır. Bu nedenle, reaktan konsantrasyonunu 2 kat arttırırsak, reaksiyon hızı 2 kat artar. İkinci dereceden reaksiyonlar, reaksiyon hızı, reaksiyona girenlerden ikisinin molar konsantrasyonuna veya reaksiyona katılan bir reaktifin ikinci gücüne bağlı olan kimyasal reaksiyonlardır. Dolayısıyla, tepken konsantrasyonunu 2 kat arttırırsak, reaksiyon hızı 4 kat artar. Aşağıdaki infografik, birinci ve ikinci derece reaksiyonlar arasındaki farkı tablo şeklinde göstermektedir.

Özet - Birinci ve İkinci Dereceden Reaksiyonlar
Reaksiyonun sırasına göre üç ana reaksiyon türü vardır; sıfır mertebe, birinci mertebe ve ikinci mertebeden reaksiyonlar. Birinci ve ikinci dereceden reaksiyonlar arasındaki temel fark, birinci dereceden bir reaksiyonun hızı, hız denklemindeki reaktan konsantrasyonunun birinci gücüne bağlıyken, ikinci dereceden bir reaksiyonun hızı, konsantrasyon teriminin ikinci gücüne bağlıdır. oran denklemi.






